Сотрудники факультета фундаментальной медицины МГУ имени М. В. Ломоносова выяснили, от чего зависит уровень онкогенного белка Mcl-1 в клетке и как можно его регулировать. Повышенное содержание этого белка приводит к устойчивости опухолей к терапии. Исследование поддержано грантом Президентской программы исследовательских проектов Российского научного фонда, реализуемых молодыми учеными. Результаты работы опубликованы в высокорейтинговом журнале Cell Death & Differentiation.
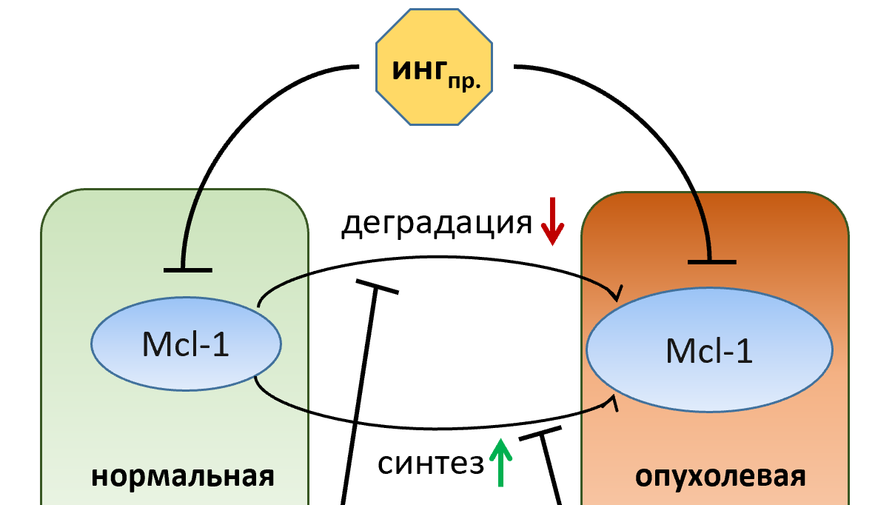
Белки семейства Bcl-2 играют важную роль в регуляции апоптоза — одного из типов программируемой клеточной гибели. Некоторые из этих белков (проапоптотические) принимают участие в процессe «самоуничтожения» потенциально злокачественных клеток, тогда как другие (антиапоптотические) противодействуют апоптозу, таким образом уравновешивая гибель и выживание клеток. Нарушения этого баланса могут привести к возникновению и развитию раковых заболеваний. Один из механизмов устойчивости опухолевых клеток к гибели — повышение в них уровня антиапоптотических белков, к числу которых относится Mcl-1. Его отличительная особенность — короткое время жизни, что делает его очень чувствительным к изменениям в процессах синтеза или деградации.
Молодые сотрудники лаборатории исследования механизмов апоптоза факультета фундаментальной медицины МГУ имени М. В. Ломоносова Вячеслав Сеничкин, Алена Стрелецкая, Анна Горбунова и руководитель проекта Гелина Копеина провели детальный анализ всех имеющихся на сегодняшний день данных, которые касаются функционирования антиапоптотического белка Mcl-1 в опухолях. Ученые исследовали способы регуляции его содержания в клетке на разных этапах, от синтеза до разрушения.
«Для того, чтобы целенаправленно воздействовать на клеточные процессы, позволяющие выживать злокачественным клеткам, необходимо понять, как именно возникает устойчивость к апоптозу. Mcl-1 — один из важных белков, защищающих опухоли от терапевтического воздействия. Его уровень определяется целым рядом регуляторных механизмов, и нарушение в работе любого из них может привести к повышению содержания Mcl-1, злокачественному перерождению клеток и их устойчивости к терапии», — рассказал кандидат биологических наук Вячеслав Сеничкин.
В рамках работы ученые проанализировали более 150 литературных источников, содержащих информацию о Mcl-1, включая данные, полученные ранее в лаборатории МГУ. Ученые предложили снижать уровень белка в опухолевых клетках с помощью «непрямого воздействия».
«Гипотеза основана на том, что на содержание Mcl-1 в клетке могут существенно влиять нарушения в работе некоторых регуляторных механизмов – например, отвечающих за быструю деградацию. Мы предлагаем одновременное воздействие на различные механизмы регуляции этого белка — так называемое «непрямое» ингибирование, или подавление. С нашей точки зрения такой подход будет более безопасной стратегией в сравнении с прямым подавлением его работы. Воздействуя таким образом на процессы, которые нарушаются при развитии опухоли, можно добиться снижения уровня Mcl-1 только в злокачественных клетках. Ингибирование же белка напрямую, напротив, будет затрагивать его содержание и в опухолевых, и в нормальных клетках. Однако, чтобы точно сказать, какая из двух стратегий является более предпочтительной, необходимы дальнейшие исследования», — объяснил заведующий лабораторией профессор Борис Животовский.
Если ученым удастся добиться специфического снижения уровня Mcl-1 в опухолевых клетках, влияя на механизмы его синтеза и распада, и гипотеза о большей эффективности «непрямого воздействия» на исследуемый белок подтвердится, то данный подход можно будет успешно использовать в качестве одного из важных методов противоопухолевой терапии.

 Цивилизация
Цивилизация