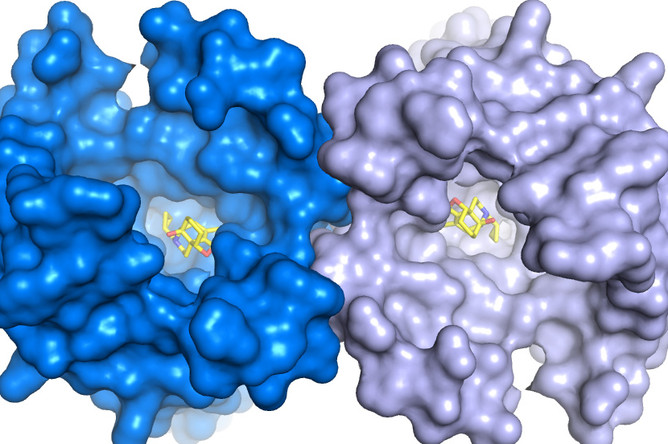
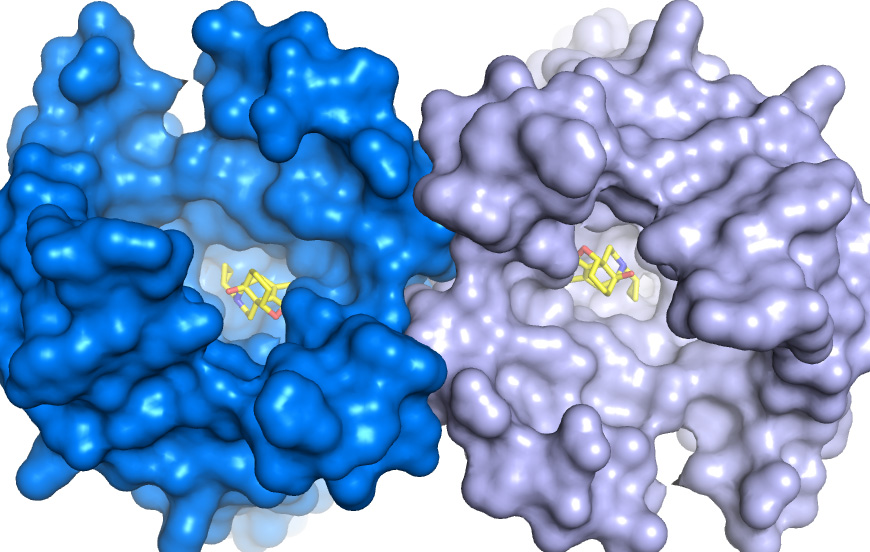
Впервые полностью определена трехмерная атомная структура двух человеческих опиоидных рецепторов — специфических молекул на контактирующей поверхности мембраны воспринимающей нервной клетки. Сразу две статьи с описанием этого открытия, которое можно рассматривать как существенный прорыв в понимании работы мозга и нервной системы, а также, потенциально, в индустрии анальгетиков, публикует сегодня Nature («Кристаллическая структура мю-опиоидного рецептора в связке с морфинным агонистом», и «Структура человеческого каппа-опиоидного рецептора в комплексе с JDTic»).
Опиоидные рецепторы — самые, наверное, широко известные нейромембранные молекулы, интерес к которым вызван ключевой ролью, которую они играют в формировании как болевых, так и приятных ощущений,
а также наркотической зависимости, депрессий, психозов, галлюцинаций и состояний измененного сознания.
Большая группа веществ, в которую входят как общедоступные анальгетики, которые продают в аптеках, так и тяжелые нелегальные наркотики и психоделики, носит название «опиоидов», поскольку их болеутоляющее, успокаивающее, эйфорическое или галлюцинозное действие основано на избирательном связывании с этими рецепторами и усилении либо подавлении их отклика на электрические и химические сигналы мозга.
В зависимости от того, с какими эндогенными (то есть производимыми самим организмом) белками-нейротрансмиттерами они связываются, различают четыре основные группы опиоидных рецепторов — μ- (мю), κ- (каппа), δ- (дельта) и ноцицептивные рецепторы. Первая греческая буква повторяет первую букву названия вещества (не обязательно эндогенного), с которыми впервые было обнаружено сродство рецептора, как, например, морфина в случае мю-рецептора или кетоциклазоцина в случае каппа-рецептора.
Детальную трехмерную структуру вплоть до пространственного расположения отдельных атомов пока удалось определить у двух из них — «мю» и «каппа».
Этим рецепторам грех жаловаться на отсутствие интереса к своей неоднозначной биохимической активности со стороны специалистов и широкой публики.
Так, мю-рецепторы отвечают за чувство удовольствия и ослабление болевых сигналов, охотно связываясь с такими нейротрансмиттерами, как эндорфины. Именно они являются главными мишенями популярных искусственно синтезированных опиоидов — морфина, героина, а также сильных анальгетиков мю-опиоидного ряда, например викодина — любимого лекарства доктора Хауса.
Каппа-рецепторы обрели славу относительно недавно в связи с широким распространением курительных смесей на основе шалфея предсказателей (Salvia divinorum) — растительного галлюциногена американских индейцев, действующее вещество которого — неоклеродановый дитерпеноид сальвинорин А — избирательно и эффективно связывается именно с ними.
В отличие от седативной функции мю-рецепторов, каппа-рецепторы, связанные сальвинорином А, резко повышающим их чувствительность к эндогенным нейротрансмиттерам динорфинам,
отвечают за эффект, несколько отличный от действия мю-рецепторов, вызывая эмоциональную неуравновешенность, подавленность, панические атаки и очень яркие галлюцинации — как правило, недоброго характера.
Между тем, как показали эксперименты над животными, активация каппа-рецепторов также снимает болевой синдром, но с одним существенным отличием: в отличие от морфина, героина и анальгетиков мю-опиоидного ряда, агонисты (вещества, повышающие рецепторный отклик) каппа-рецепторов не вызывают привыкания. Поэтому, если удастся модифицировать их формулу так, чтобы свелся к минимуму непредсказуемый психотический эффект,
медики получат в распоряжение сильные болеутоляющие лекарства нового поколения без «наркотической ауры», с которой никак не хотят расставаться мю-опиоидные агонисты.
«Теперь, зная строение каппа-рецептора и точную форму его молекулы, фармацевты могут существенно ускорить работу», — считает Брайан Рот, биохимик из Университета Северной Каролины, участвовавший в расшифровке рецептора, один из авторов статьи в Nature.
Впрочем, интерес для фармацевтов представляют не только агонисты, но и антагонисты, блокирующие активность каппа-рецепторов, которые можно использовать для лечения депрессий, тревожности, эмоциональной подавленности и прочих дискомфортных состояний, с которыми хорошо знакомы курильщики шалфея предсказателей, действующего как каппа-активатор.
Мощный психоделический эффект каппа-активации тоже не стоит игнорировать при изучении механизмов восприятия, сознания и конструирования мозгом картины мира.
«По всей видимости, каппа-рецепторы играют очень важную роль в нашем восприятии реальности»,
— подчеркнул Рот в одном из пресс-релизов публикации. После нескольких десятилетий запретов на научное изучение психоделиков работы в этой области, наконец, активизировались, и об одном из таких исследований мы уже писали.
Работа по расшифровке каппа-рецептора велась в несколько стадий.
Сначала была решена нетривиальная задача по выделению и сохранению нестабильной молекулы рецептора, выделенной из культуры нервных клеток гусениц генномодифицированной моли (Spodoptera frugiperda), несущих ген, отвечающий за экспрессию каппа-рецепторного белка человеческого типа. Сделать это удалось, надежно стабилизировав нужный белок с помощью молекулы-антагониста — экспериментального лекарства JDTic (одного из производных 4-фенилпиперидина), избирательно блокирующего каппа-рецептор.
Далее методом рентгеноструктурного анализа, использующего эффект дифракции рентгеновских лучей на трехмерной кристаллической решётке, была установлена атомная структура и 3D-форма кристаллизованного комплекса молекулы каппа-рецептора и стабилизирующей ловушки — молекулы антагониста. Наконец, отсоединив от получившейся 3D-модели молекулу JDTic и сделав необходимую коррекцию,
исследователи получили точную трехмерную модель каппа-рецептора с разрешением 2,9 ангстрем.
По той же схеме, только с участием генномодифицированных мышей и другой разновидности антагониста-ловушки, была получена трехмерная модель мю-рецептора, которая поможет понять, как именно стыкуются с его молекулой различные опиоидные лиганды, не дающие спокойно спать сотрудникам служб наркоконтроля. Что, в свою очередь, также поможет очистить от побочных эффектов действие опиоидных лекарств, воздействующих на мю-рецепторы.
Сложнейшая работа по расшифровке двух важнейших опиоидных рецепторов велась силами нескольких американских лабораторий и институтов под руководством общего фонда Национальных институтов здравоохранения (NIH, США) в рамках долговременной финансируемой государством инициативы по структурному изучению белков, а также федеральной научной программы по изучению рецепторов, сопряженных с G-белком (G protein-coupled receptors network). Из примерно 800 таких рецепторов к настоящему моменту расшифрована атомарная 3D-структура всего 11. Нарушение работы этих рецепторов приводит к возникновению множества различных заболеваний, а сами рецепторы являются мишенью почти половины номенклатуры всех выпускаемых сейчас лекарств.

 Цивилизация
Цивилизация